我们团队的第一代疫苗的1期临床试验DP6-001于2004 – 2006年进行,目的是测试第一代多价DNA初免 /蛋白质加强疫苗的安全性和免疫原性。该疫苗是基于20世纪90年代当时可获得的有限数量的艾滋病毒临床分离株而设计的,使用QS-21作为佐剂。
ClinicalTrials.gov 编号: NCT00061243
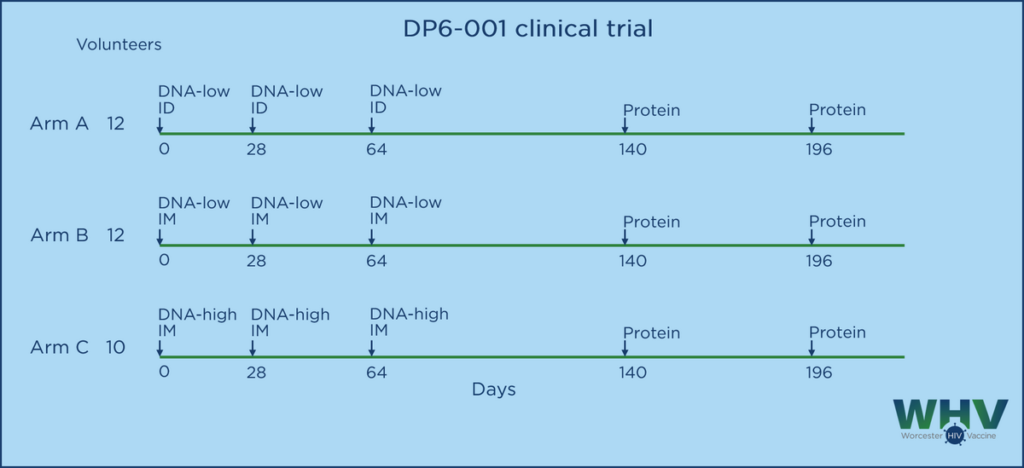
附图说明:DP6-001是一项随机、开放标记的I期临床试验,其中三组志愿者在DNA初免方法上有所不同。A组接受皮内注射1.2mgDNA(低DNA组,ID),B组接受肌肉注射1.2 DNA(低DNA组,IM),C组接受肌肉注射7.2mg DNA(高DNA组,IM)。所有组均给予肌肉注射两次重组蛋白(每次0.375 mg)进行加强,并辅以佐剂QS21 (50 μg)
结合抗体滴度
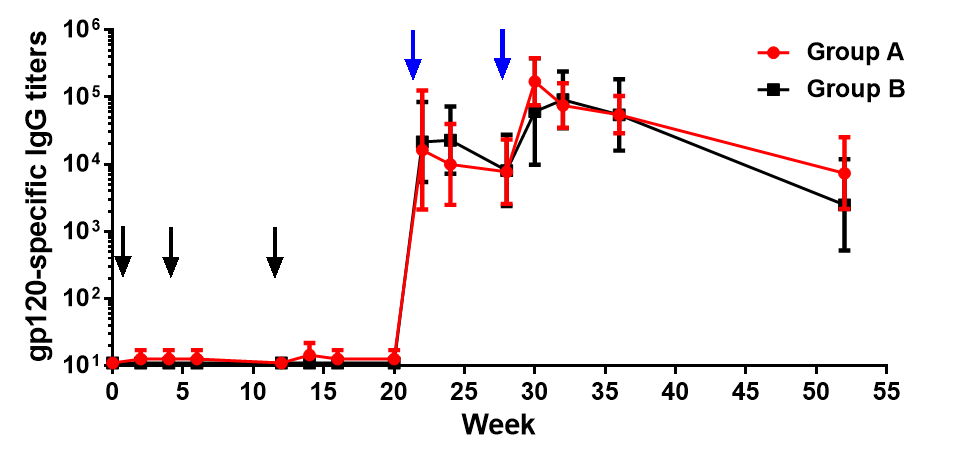
在接受低剂量DNA组,大多数志愿者在接受3次DNA免疫后不可检测到包膜蛋白特异性抗体应答。然而,抗体滴度在仅一次蛋白质加强免疫后迅速上升。抗gp120的 IgG抗体滴度达到与慢性感染HIV患者相当的水平(即1:100000或更高)。在第52周整个试验结束时,两组参加者血清抗gp120的 IgG滴度都能维持较高水平。此外,蛋白质印迹分析显示,志愿者血清中诱导的抗体对11种异源性艾滋病毒野株的gp120抗原具有广谱的反应 (Wang, 2008)。
病毒中和活性
中和抗体活性的检测表明,所有接种该疫苗的志愿者血清对3种敏感的1A类病毒具有高滴度中和抗体应答。 进一步做针对A至E亚型的11种异源病毒的中和抗体测试, 结果显示,大多数志愿者对至少一半表达临床分离株包膜蛋白抗原的假型病毒具有中和活性 (Wang, 2008),这些中和抗体的滴度高于先前文献报道的包括DNA疫苗在内的各种艾滋病毒疫苗设计。
ADCC活性
抗体依赖性细胞毒性(ADCC)是抗体的一个重要功能,可以有效杀死被感染的细胞。从DP6-001志愿者中分离出一系列人源单克隆抗体,它们具有高效广谱的ADCC活性 (Costa, 2016)。此外,在一些DP6-001志愿者的血清中也直接检测到了ADCC抗体活性,并且每次免疫后滴度递增。 我们计划开展进一步研究,分析整个DP6-001志愿者群体的血清ADCC抗体活性。
T细胞免疫
该疫苗还在志愿者中诱导了细胞介导的免疫。100%的志愿者产生由多功能CD4+ T细胞介导和包膜蛋白特异性的IFN-γ反应 (Bansal, 2008)。在DNA高剂量组中也检测到艾滋病毒特异性的CD8 +T细胞应答,但有此反应的志愿者比例较低。

